Informasjon over og utenfor DNA-koden
(Fra: The Mysterious Epigenome; Ch.7-8; Th.E.Woodward; J.P.Gills; Kregel Publications; 2012)
Vi skal undersøke litt omkring hvordan en zygote (befruktet eggcelle) kan utvikle seg til all slags vev og organer. F.eks. inneholder en menneskelig skulder ca. to billioner celler, med ulike slags cellevev: muskelfibre, nervenettverk og beinstrukturer. Hvert element er briljant stilt opp og sammenflettet på et perfekt fungerende vis. Hver del har sin rolle i å støtte og muliggjøre normal bevegelse av forbindelsene. Om vi sammenligner skulderens formasjon i livmoren og dens endelige mål i en voksen, moden form og funksjon, skjønner vi at det starter på molekylært nivå. Men hva er det som muliggjør nødvendig celle-differensiering? Hva ‘setter opp’ det unike livet til hver type spesialisert celle innen systemet? Kan epigenomet ha svar på denne gåten?
Bilde 1 Over 200 celletyper i menneskekroppen
Slik det ser ut, har epigenomet vist seg å være den molekylære nøkkelen til skulderens utvikling. I hvert stadium er hver celle ledet til sin unike bruk av DNA-filene ved hjelp av det epigenom-systemet, som sitter over, men er i nærkontakt med den genetiske rikdommen i DNA. Senere skal vi se på hvordan det en tidligere kalte 'junk-DNA' spiller en vital rolle i samordning av cellulær utvikling, i samarbeid med epigenetisk informasjon. I menneske- kroppen er det over 200 celletyper, og hver av dem har sitt eget epigenom. Det er i sterk kontrast til genomet, som er det samme i samtlige av kroppens celler. Hver celletype har altså ett unikt sett av epigenetisk programvare, hvis instruksjoner passer spesielt for den celletypen.
Om en skal gjennomføre et tilsvarende prosjekt som for Human Genome Project som bare trengte å kartlegge ett informasjonssystem, så har et påbegynt Human Epigenom Project en mye mer avskrekkende oppgave, å kartlegge mer enn to hundre ulike informasjonssystemer. National Institutes of Health har allokert ca. 200 millioner USD, til et prosjekt kalt ‘The Epigenomic Roadmap’, som er første steg på veien til å spore hvert ørlite epigenom i hver unik celletype, i menneskekroppen. Så langt har en funnet at prosessene som varierer mye fra celletype til celletype, blir styrt fra en kilde utenfor DNA. At DNA selv styres av ett system over DNA, er et av sjokkene som fagmiljøet har opplevd i senere år.

Bilde 2 Celletyper en stamcelle kan differensieres til
Realitetssjekk
At en mengde ulike celler, som har identisk genom, samarbeider i å bygge kropper, er ett av de sentrale problemene å forholde seg til (2). Wade sammenlikner de varierte oppgavene til menneskeceller, med en situasjon der ulike aktører leser fra samme masterscript, mens tilleggs-instruksjoner, over og utenfor scriptet blokkerer aktørene fra de delene som ikke angår dem. Innenfor samlingen av levende celler, trenger ikke hver celletype se hele gensettet (DNA-scriptet). Genene i de deler av DNA-scriptet som ikke er aktuell for en spesifikk celletype, vil ikke bli aktivert. De stenges av med epigenetiske markører. I følge Wade har forskere kommet til at for de like celletypene, må det være ulike sett av arvelige instruksjoner, skrevet over og utenfor DNA-koden. Disse instruksjonene avgjør hvilke instruksjoner i masterscriptet som åpnes, og hvilke som holdes utilgjengelige.
Mysteriet med hvordan denne molekylære konstruksjonsprosessen styres, og valget av en spesifikk master-plan for hver celletype har fascinert biologer i årtier. Hvordan tilegnes cellene til de ulike rollene de vil spille gjennom en persons levetid. Epigenomet kontrollerer tilgang til genene som tillater hver celletype å aktivere spesielle gener, mens mange andre blokkeres. Nå tror noen forskere at epigenomet er involvert, ikke bare i å definere hvilke gener som er tilgjengelige, men også i prosessen å aktivere de tilgjengelige cellene (fra Wade, “From one Genome”). På dataspråk: Epigenomet representerer programspråket for genomets filsystem, liksom et SQL-program henter ut data fra en database. Epigenomet styrer altså DNAet til å danne de mange ulike kropps-organer og vev, fra en stamcelle (zygoten).
Hvordan blir de mange varianter av epigenomet etablert? Hvordan endres de etter at det initielle epigenomet starter sin kontrollstyring i zygoten? Hvordan kan det fra én stamcelle folde seg ut to hundre ulike celletyper? Vi må tilbake til de tidligste stadier av utvikling av embryoet.
På ett eller annet vis initierer epigenomet i zygoten en differensiering til dusinvis av ulike vevstyper. Men hvilket system styrer editeringen av genomet? Det er en prosess som må gjøres om igjen, dusinvis av ganger, i det celler differensieres ut fra startpunktet. Evolusonsbiologer, vil ut fra invervjuer (Wade, “From one Genome”), hevde at DNA editerer epigenomet, ‘når det trengs’, og at epigenomet så redirigerer DNA-bruken på nye måter, i det nye celler oppstår. Ut fra en utviklingstankegang er det litt rart å forestille seg at blinde, formålsløse krefter, skal vite når ting trengs {når de ikke har noe formål i sikte -oversetters kommentar}. Selv om det kan være noe sant i et slikt sirkelargument, synes det som en rar årsaks/virknings-kjede. Men den mest fundamentale oppbygningen av nye kroppsformer, krever en epigenetisk programmering. Det synes ikke naturlig at seleksjon som virker på naturlig utvalg og mutasjoner, uten noen selektiv fordel -skulle bygge dette gradvis opp.
Det har vært gjort forsøk med zygoten der en har påvist at endringer medfører arvelige komplikasjoner. Noen biologer holder for at hele den tredimensjonale strukturen til zygoten påvirker cellens skjebne. Det presise molekylære mønsteret i zygotens indre, har blitt foreslått som den høyeste epigenetiske koden. Den er på en måte masterkoden. Vi kan kalle den zygote-koden. Når zygoten er på randen til celle-deling, synes det ut fra erfaring å være et mål i sikte. Det er litt merkelig om endimensjonal DNA alene, kan utvikle tre-dimensjonale strukturer til dyreformer, trær eller mennesker.
Bilde 3 Centrosome-mikrotubule, cortex
 J. Wells har lansert en teori, som foreløpig er rimelig kontroversiell. Den går ut på at visse strukturelle mønstre i zygoten, bærer på det Wells kaller ‘ontogenetisk’ informasjon. (Ontogeni, individutviklingen hos de enkelte arter fra egg-stadium til alderdomsdød.) Wells mener det er epigenomet via en sentral struktur i cellen, centrosom , som innehar en nøkkel i dannelse av kroppsform. Dette runde elementet i cellen, plassert i nærheten av kjernen, har flere ulike funksjoner. En av dem er å være senter for de lange utstrålingene som kalles mikrotubuler. Disse fungerer som cellens kommunikasjons-nettverk, cellearbeidere kan ‘spasere’ langs, og gjøre nødvendig vedlikeholdsarbeid. Centrosomen har to viktige elementer, kalt centrioler, som står vinkelrett på hverandre. J. Wells mener disse fungerer i likhet med ørsmå turbiner. Det er grunn til å spørre hvilke konsekvenser det nye i forbindelse med epigenomet, har å si for vårt syn på opprinnelsen. Etter å ha sett på nyeste vitenskapelige bevis, er det grunn til å spørre hva eller hvem som var opphavet til dette massive informasjonshierarkiet?
J. Wells har lansert en teori, som foreløpig er rimelig kontroversiell. Den går ut på at visse strukturelle mønstre i zygoten, bærer på det Wells kaller ‘ontogenetisk’ informasjon. (Ontogeni, individutviklingen hos de enkelte arter fra egg-stadium til alderdomsdød.) Wells mener det er epigenomet via en sentral struktur i cellen, centrosom , som innehar en nøkkel i dannelse av kroppsform. Dette runde elementet i cellen, plassert i nærheten av kjernen, har flere ulike funksjoner. En av dem er å være senter for de lange utstrålingene som kalles mikrotubuler. Disse fungerer som cellens kommunikasjons-nettverk, cellearbeidere kan ‘spasere’ langs, og gjøre nødvendig vedlikeholdsarbeid. Centrosomen har to viktige elementer, kalt centrioler, som står vinkelrett på hverandre. J. Wells mener disse fungerer i likhet med ørsmå turbiner. Det er grunn til å spørre hvilke konsekvenser det nye i forbindelse med epigenomet, har å si for vårt syn på opprinnelsen. Etter å ha sett på nyeste vitenskapelige bevis, er det grunn til å spørre hva eller hvem som var opphavet til dette massive informasjonshierarkiet?
Les mer om kroppsdannelse og det finjusterte nettverk som administrerer dette her.
Du finner mer om epigenetikk her.
Zygoten og befruktning
Rundt en menneskelig eggcelle, er det en tykk membran. Cortex (det ytterste laget på et organ) har tre deler: i) Celle-membranen, som penetreres av spermie. Ii) De spesielle proteinene som membranen inneholder. F.eks. ZP3, som fungerer som supersensorer, og skal hjelpe ved befruktnings-prosessen. iii)Ytre cytoplasma som inneholder oppløste næringsmidler og andre kjemikalier. Mønstre av vital informasjon er innkranset i cortex, og vi har sett av eksperimenter at dette kan leveres til datterceller, selv om informasjonen er utenfor cellens DNA. Forskere har kalt fenomenet med overføring av et epigenetisk karakteristika i en levende organisme, for strukturell (cortical) arv.
Bilde 4: Spermie med bl.a. centrioler
 De første tegn på strukturell arv så en på 1960/70-tallet. Da cellen var klar for reproduksjon, forsøkte et team under ledelse av Tracey Osborn å snu retning på en av de såkalte padleårene, som stakk ut i hundretalls fra det ytre av cellen. En slik ‘padleåre’ (cilia) ble snudd i 180 grader, og vendte motsatt retning. I påfølgende generasjoner fortsatte disse padleårene’ å vende motsatt vei, til tross for at deres DNA var helt uforandret i de cellene. Forskere brukte ordet ‘blåkopi’ for å karakterisere layout- instruksjonene inneholdt i cellens romlige 3-D arkitektur. Det er nylig oppdaget at eggcellen mangler en centrosom før befruktning. Enten må den dannes raskt etterpå, og/eller så kan spermien bringe med seg innholdet i form av en centrioler, i tillegg til DNA.
De første tegn på strukturell arv så en på 1960/70-tallet. Da cellen var klar for reproduksjon, forsøkte et team under ledelse av Tracey Osborn å snu retning på en av de såkalte padleårene, som stakk ut i hundretalls fra det ytre av cellen. En slik ‘padleåre’ (cilia) ble snudd i 180 grader, og vendte motsatt retning. I påfølgende generasjoner fortsatte disse padleårene’ å vende motsatt vei, til tross for at deres DNA var helt uforandret i de cellene. Forskere brukte ordet ‘blåkopi’ for å karakterisere layout- instruksjonene inneholdt i cellens romlige 3-D arkitektur. Det er nylig oppdaget at eggcellen mangler en centrosom før befruktning. Enten må den dannes raskt etterpå, og/eller så kan spermien bringe med seg innholdet i form av en centrioler, i tillegg til DNA.
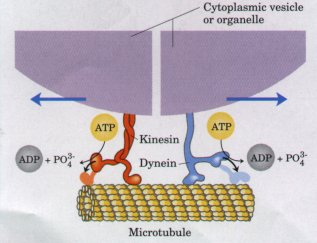
Bilde 5: Kinesin og dynein: hvor får de informasjon fra?
I en bok(kilde) av Richard Francis sier han: “I det tradisjonelle synet, fungerer genene utøvende i å styre kursen for vår utvikling. I det alternative synet .. hviler den utøvende funksjonen på celle-nivå, og genene fungerer mer lik cellulære ressurser.” Den utøvende (executive) celle harmonerer bra med begrepet “zygote-kode”. Men Francis’ begrep strekker seg til hver levende celle. Om dette synet er riktig, vil vi etter hvert oppdage et forbløffende informasjonsnettverk i cellen.
Til sist kan vi ta med at når en oppdager vandrende cellearbeider, lik kinesin, som vandrer langs mikrotubulene ut fra centrosomen, er det vanskelig å forklare hvorfra den får informasjon om hva den skal utføre, hvor den skal, samt at de kan samarbeide etc. ut fra én-dimensjonal DNA-informasjon. Det er forhold som i det minste er lettere å forstå ut fra cellulært nivå, der hele cellens romlige struktur er med å styre aktiviteten, og muligens centrosomen spiller en nøkkelrolle.
{Forsøk på oppsummering: Epigenetiske endringer innbefatter alle endringer av gen-uttrykk i DNA-genom og tilhørende histon-proteiner, uten endring i gensekvensen (rekkefølge av basepar/nukleotider)-oversetters tilføyelse}.
Oversatt og bilder ved Asbjørn E. Lund



 J. Wells har lansert en teori, som foreløpig er rimelig kontroversiell. Den går ut på at visse strukturelle mønstre i zygoten, bærer på det Wells kaller ‘ontogenetisk’ informasjon. (Ontogeni, individutviklingen hos de enkelte arter fra egg-stadium til alderdomsdød.) Wells mener det er epigenomet via en sentral struktur i cellen, centrosom , som innehar en nøkkel i dannelse av kroppsform. Dette runde elementet i cellen, plassert i nærheten av kjernen, har flere ulike funksjoner. En av dem er å være senter for de lange utstrålingene som kalles mikrotubuler. Disse fungerer som cellens kommunikasjons-nettverk, cellearbeidere kan ‘spasere’ langs, og gjøre nødvendig vedlikeholdsarbeid. Centrosomen har to viktige elementer, kalt centrioler, som står vinkelrett på hverandre. J. Wells mener disse fungerer i likhet med ørsmå turbiner. Det er grunn til å spørre hvilke konsekvenser det nye i forbindelse med epigenomet, har å si for vårt syn på opprinnelsen. Etter å ha sett på nyeste vitenskapelige bevis, er det grunn til å spørre hva eller hvem som var opphavet til dette massive informasjonshierarkiet?
J. Wells har lansert en teori, som foreløpig er rimelig kontroversiell. Den går ut på at visse strukturelle mønstre i zygoten, bærer på det Wells kaller ‘ontogenetisk’ informasjon. (Ontogeni, individutviklingen hos de enkelte arter fra egg-stadium til alderdomsdød.) Wells mener det er epigenomet via en sentral struktur i cellen, centrosom , som innehar en nøkkel i dannelse av kroppsform. Dette runde elementet i cellen, plassert i nærheten av kjernen, har flere ulike funksjoner. En av dem er å være senter for de lange utstrålingene som kalles mikrotubuler. Disse fungerer som cellens kommunikasjons-nettverk, cellearbeidere kan ‘spasere’ langs, og gjøre nødvendig vedlikeholdsarbeid. Centrosomen har to viktige elementer, kalt centrioler, som står vinkelrett på hverandre. J. Wells mener disse fungerer i likhet med ørsmå turbiner. Det er grunn til å spørre hvilke konsekvenser det nye i forbindelse med epigenomet, har å si for vårt syn på opprinnelsen. Etter å ha sett på nyeste vitenskapelige bevis, er det grunn til å spørre hva eller hvem som var opphavet til dette massive informasjonshierarkiet? De første tegn på strukturell arv så en på 1960/70-tallet. Da cellen var klar for reproduksjon, forsøkte et team under ledelse av Tracey Osborn å snu retning på en av de såkalte padleårene, som stakk ut i hundretalls fra det ytre av cellen. En slik ‘padleåre’ (cilia) ble snudd i 180 grader, og vendte motsatt retning. I påfølgende generasjoner fortsatte disse padleårene’ å vende motsatt vei, til tross for at deres DNA var helt uforandret i de cellene. Forskere brukte ordet ‘blåkopi’ for å karakterisere layout- instruksjonene inneholdt i cellens romlige 3-D arkitektur. Det er nylig oppdaget at eggcellen mangler en centrosom før befruktning. Enten må den dannes raskt etterpå, og/eller så kan spermien bringe med seg innholdet i form av en centrioler, i tillegg til DNA.
De første tegn på strukturell arv så en på 1960/70-tallet. Da cellen var klar for reproduksjon, forsøkte et team under ledelse av Tracey Osborn å snu retning på en av de såkalte padleårene, som stakk ut i hundretalls fra det ytre av cellen. En slik ‘padleåre’ (cilia) ble snudd i 180 grader, og vendte motsatt retning. I påfølgende generasjoner fortsatte disse padleårene’ å vende motsatt vei, til tross for at deres DNA var helt uforandret i de cellene. Forskere brukte ordet ‘blåkopi’ for å karakterisere layout- instruksjonene inneholdt i cellens romlige 3-D arkitektur. Det er nylig oppdaget at eggcellen mangler en centrosom før befruktning. Enten må den dannes raskt etterpå, og/eller så kan spermien bringe med seg innholdet i form av en centrioler, i tillegg til DNA.